0 引言
随着人口老龄化和脑卒中生存率的改善,脑卒中患者不断增加。卒中后神经系统后遗症导致的运动控制障碍给脑卒中患者的活动模式带来了极大的负面影响,长时间的活动缺乏导致运动耐量受损,生物力学效能的低下又增加偏瘫步态的能量需求,加重脑卒中患者的运动不耐受。运动不耐受表现为有氧运动能力降低,这种活动时的不适和疲劳感会降低患者对康复治疗的依从性,甚至进一步加重运动功能障碍,形成恶性循环。
心肺适能(cardiorespiratory fitness,CRF)是体适能的重要组成部分,是衡量脑卒中患者运动耐量的经典指标。CRF反映呼吸和循环系统向骨骼肌供氧及骨骼肌利用氧气产生能量以满足运动所需的综合能力。通过心肺运动试验 (cardiopulmonary exercise testing,CPET)测得的最大摄氧量(maximal oxygen consumption,VO2max)或峰值摄氧量(peak oxygen consumption,VO2peak)被认为是量化CRF的金标准。除了量化CRF,CPET通过在递增负荷运动试验期间将通气和气体交换测量参数与心电、血压、脉搏血氧参数相结合,提供运动期间心、肺和骨骼肌功能的多变量评估,这些衍生的CPET数据可以识别导致运动受限的重要器官系统的功能障碍。
脑卒中后更高的CRF水平与更好的功能改善相关,但目前,卒中后康复的重点大多集中于神经功能的恢复,而忽略了这部分患者群体可能存在的运动不耐受问题。既往的研究显示,脑卒中患者CRF水平显著降低,低水平的CRF不仅限制脑卒中患者在亚急性期和慢性期的功能恢复,也增加了卒中后死亡的风险,但卒中后CRF下降的具体原因尚未被阐明。
本研究采用CPET及其衍生参数分析脑卒中患者在心、肺、骨骼肌方面的特征性变化,并进一步探讨该群体运动不耐受的潜在病理生理机制,为CRF干预和进一步的针对性康复治疗提供依据。
1 资料与方法
1.1 一般资料
2021年2月至2023年7月,选取在上海市复旦大学附属华山医院静安分院康复医学科接受住院康复治疗的脑卒中偏瘫患者92例,符合《中国急性缺血性脑卒中诊治指南2018》或《中国脑出血诊治指南(2019)》缺血性脑卒中或出血性脑卒中的诊断标准,并由头颅CT或MRI检查证实。
脑卒中患者纳入标准:
①年龄18~80岁,性别不限;
②首次脑卒中,病程>7d,存在偏瘫;
③生命体征平稳,无CPET的绝对和相对禁忌证,能配合完成CPET指令;
④理解本研究,自愿参与并签署知情同意书。
脑卒中患者排除标准:
①有严重或难以控制的高血压、严重的心功能不全、严重的感染(肺炎等)、糖尿病酮症、频发癫痫等临床医生认为运动可能导致恶化的疾病;
②存在未控制的临床情况(甲状腺功能亢进或减退、严重肝肾功能损害、风湿疾病急性活动期、电解质紊乱、严重贫血等);
③房颤、使用β受体阻滞剂等影响心率的药物、血红蛋白浓度不在正常范围内;
④参与其他临床试验。
排除中途要求退出者2例、未达到终止标准自行中止运动者6例、最大呼吸交换比 (respiratory exchange ratio,RER)未达到1.0者5例,最终纳入有效脑卒中患者79例。
在社会面不定向招募与有效脑卒中患者性别相同、年龄相近的健康受试者12例。
健康受试者纳入标准:
①无脑卒中等神经系统疾病病史;
②与脑卒中患者性别相同,年龄相差≤7岁;
③ 无CPET的绝对和相对禁忌证,能配合完成CPET 指令;
④理解本研究,自愿参与并签署知情同意书。
健康受试者排除标准:
①有严重基础疾病、骨关节疾病等医生认为不适合行CPET评估或运动可能导致恶化的疾病;
②房颤、使用 β受体阻滞剂等影响心率的药物、血红蛋白浓度不在正常范围内;
③参与其他临床试验。
脱落与剔除标准:
①中途要求退出本研究;
②未达到CPET终止标准自行停止运动;
③RER<1.0。
本研究经复旦大学附属华山医院伦理审查委员会批准(No.(2021)临审第(985)号),并在中国临床试验中心注册(No.ChiCTR2200056043)。
1.2 方法
所有受试者均接受常规康复治疗,未接受过特殊干预。所有受试者均进行CPET评估。
1.2.1 一般资料
收集受试者的一般临床资料,包括性别、年龄、身高、体质量、既往病史和用药情况等,并采集CPET数据及血压、心电、脉搏血氧饱和度。
1.2.2 CPET
采用PowerCube-Ergo型运动心肺功能测试系统。研究者在静息肺功能测定阶段完成通气功能和每分钟最大通气量的测定,静息3min后受试者进行热身运动3min。采用功率每分钟线性增加15W的负荷递增方案,要求受试者保持约50r/min 的运动节奏,持续运动至达到终止标准。受试者达到终止标准后进行整理运动以降低心血管意外发生的风险,缓解疲劳。
测试过程中受试者出现以下任一情况即终止试验:
①运动时最大RER超过1.05;
②摄氧量曲线出现平台(随着功率的增加,摄氧量停滞或未能增加 150mL/min);
③心率达到预测最大心率的85%;
④在 6~20的Borg量表中,自我感知的用力等级>17;
⑤血压达到收缩压>200mmHg或舒张压>120mmHg;
⑥运动时脉搏血氧饱和度较基线下降5%以上;
⑦出现胸痛、头晕、缺血性心电图改变(ST段出现下垂、水平、缓慢上斜型下移≥0.1mV,持续2min以上或ST段弓背向上抬高≥0.1mV,持续时间>1min)、血压比最高值下降>20mmHg、呼吸困难、严重心律失常、肌肉骨骼疼痛等医生判定需终止运动的严重临床症状与体征;
⑧无法保持超过40r/min的运动节奏。
气体参数由流量传感器和气体分析仪收集并实时计算呼吸流量、体积和气体浓度。收集CPET参数:摄氧量(oxygen uptake,VO2)、二氧化碳呼出量(carbon dioxide discharge,VCO2)、每分钟通气量(minute ventilation volume,VE)及衍生参数峰值氧脉搏(O2 pulse peak)、通气储备(VEpeak/MVV)、峰值死腔分数(VD/VTpeak)、无氧阈占峰值摄氧量预计值百分比(AT/VO2peak%pred)。
1.3 统计学分析
采用SPSS25.0进行统计学分析,计数资料以频数表示,计量资料符合正态分布,以(x̅±s) 表示。配对的两组数据若差值服从正态分布,采用配对样本t检验;若差值不服从正态分布,采用Wilcoxon符号秩检验。采用多元线性回归模型分析脑卒中患者CRF的主要影响因素,多元线性回归分析中的控制变量筛选采用单因素线性分析。显著性水平α=0.05。
2 结果
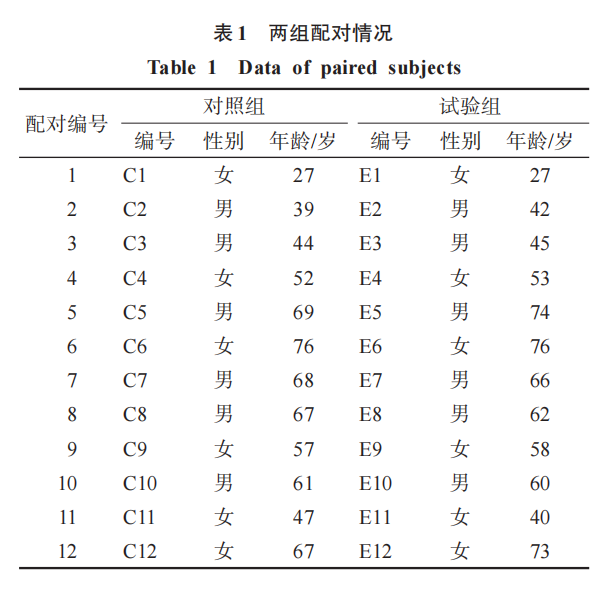
2.1 配对情况
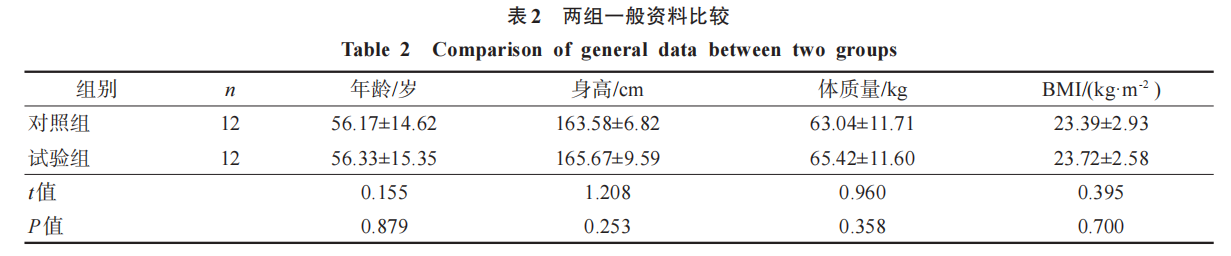
将12例健康受试者(对照组)与12例脑卒中患者(试验组)进行配对,要求性别相同、年龄相近,试验组和对照组男女各占50%,配对情况见表1。两组年龄、身高、体质量、体质量指数(body mass index,BMI)比较无显著性差异(P >0.05)。见表2。试验过程中无不良事件发生。
2.2 CPET
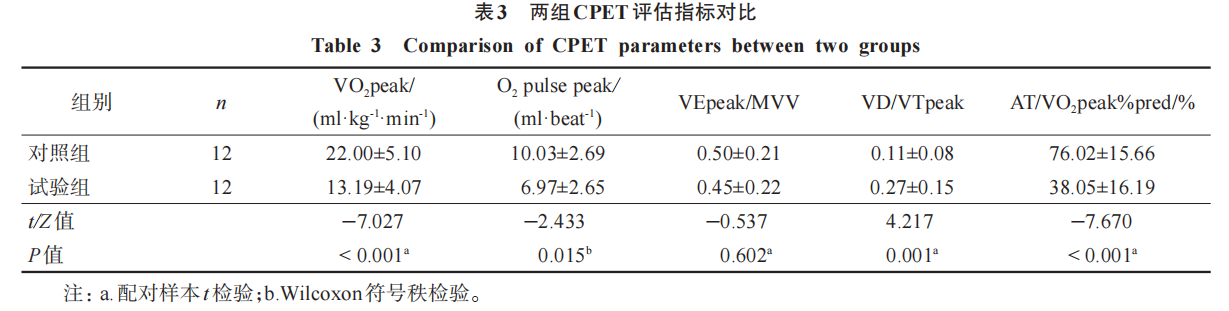
试验组VO2peak、AT/VO2peak%pred 显著低于对照组(P<0.001);试验组VD/VTpeak 明显高于对照组(P<0.01);试验组的O2 pulsepeak 低于对照组(P<0.05)。两组VEpeak/MVV 比较无显著性差异 (P> 0.05)。见表3。
2.3 脑卒中偏瘫患者CRF的回归分析
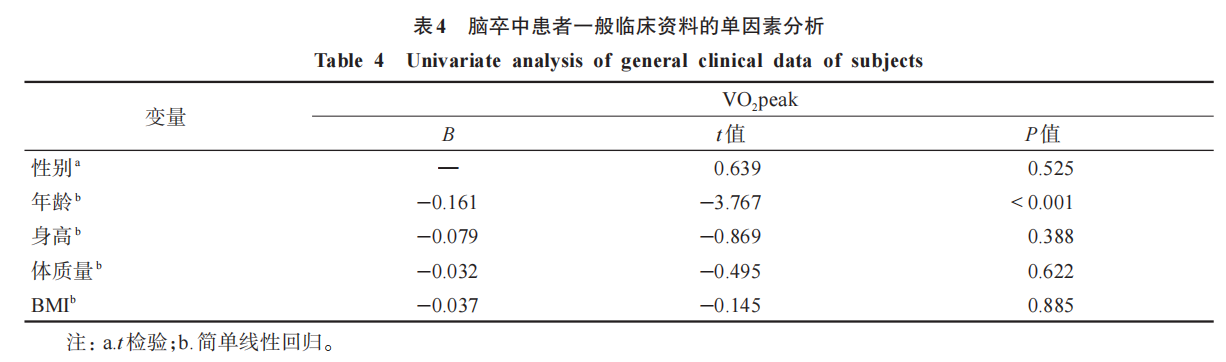
性别、年龄、身高、体质量和BMI为可能影响脑卒中受试者VO2peak 的临床变量。以VO2peak为因变量,单因素分析结果显示,脑卒中患者性别、身高、体质量和BMI与VO2peak不相关(P>0.05),年龄与VO2peak相关(P<0.05)。见表4。将年龄作为控制变量纳入多元线性回归模型。
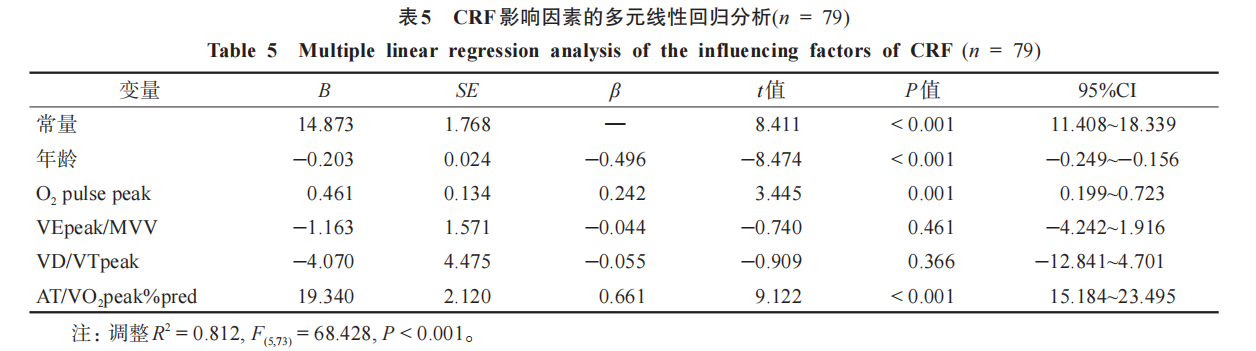
以VO2peak为因变量,选择自变量O2 pulsepeak、VEpeak/MVV、VD/VTpeak、AT/VO2peak%pred 及控制变量年龄进入回归方程进行多元线性回归分析。本次多元线性回归模型具有统计学意义(P <0.001),自变量之间不存在多重共线性(所有自变量的 VIF值均< 5),残差服从正态分布。结果显示,排除年龄的混杂干扰后,O2 pulsepeak、AT/VO2peak%pred 是脑卒中偏瘫患者 CRF 的主要影响因素 (P <0.05), AT/VO2peak%pred 对 CRF 的影响最大(B =19.340),呈正相关;VEpeak/MVV、VD/VTpeak 不是脑卒中偏瘫患者CRF的主要影响因素(P >0.05)。见表5。
![]()
![]()
3 讨论
CRF是心肺供氧能力和骨骼肌用氧能力的综合体现。针对脑卒中患者CRF的改变,本研究提出3种可能的病理生理机制作为CRF损害的主要原因,即心源性、肺源性(包括通气功能和换气效率)和骨骼肌源性因素。通过CPET大量的衍生数据可以描述脑卒中患者的心、肺、骨骼肌功能状态,识别患者运动不耐受的器官系统特异性限制,分析脑卒中患者运动不耐受的严重程度及其潜在的外周机制。卒中后这些外周组织水平的变化可导致患者CRF受损,加重功能障碍,并增加心血管风险。这些继发性生物学异常,也是卒中后治疗性运动的可能靶点。
CPET测得的VO2max被定义为在递增负荷运动试验中,随着运动负荷的增加,VO2曲线出现平台期时所达到的最大值。考虑到脑卒中患者心肺能力和肢体功能的限制,在出现运动症状限制之前,可能无法达到明确的平台。因此,参考既往研究,本研究采用VO2peak 来量化患者的CRF。VO2peak 为在递增负荷运动试验中患者达到运动试验终止标准前获得的最高VO2。VO2peak 的值取决于年龄、性别、体质量、身高和身体活动水平等。本研究采用配对样本 t检验,以最大限度避免年龄、性别对试验结果的干扰。结果显示,脑卒中患者的 VO2peak显著低于健康对照,低水平的CRF使患者无法耐受相对高强度的康复治疗,成为脑卒中康复的瓶颈。尽管VO2peak 可以量化CRF,但它不能解释卒中后有氧运动能力受限的原因,需要CPET的衍生参数才能进一步确定潜在病因。
O2 pulse是摄氧量与心率的比值,是心脏每次射血输入主动脉的氧气量,反映运动过程中循环系统的效率。O2 pulsepeak 在某种程度上反映了左心室的功能,可作为峰值运动时心脏每搏输出量的替代测量方法。对于存在心脏限制的脑卒中患者,由于心脏每搏输出量的下降,需要增加心率来维持有氧运动所需的心排血量。因此,在CPET的递增负荷运动中,O2 pulse 在患者达到峰值运动之前就开始下降,这反映心源性的运动限制。本研究中,脑卒中偏瘫患者的O2 pulse peak 低于健康对照,多元线性回归分析结果显示,O2 pulse peak 是脑卒中偏瘫患者 CRF 的主要影响因素之一。因此,卒中后的康复不应只局限于肢体功能的恢复,心功能的恢复同样重要。将心脏康复列入脑卒中患者的康复计划中,不仅有利于提升CRF水平,提高康复训练适应性,也可降低心血管危险因素和卒中复发风险。
通气储备是衡量运动时峰值每分钟通气量(peak minute ventilation,VEpeak)和静息时最大自主通气量(maximal voluntary ventilation,MVV)之间关系的指标,可用VEpeak/MVV表示,VEpeak/MVV>0.8被视为运动时通气限制的证据。除了有氧能力极高的运动员,健康人在递增负荷运动过程中,VE 会增加,但不会达到 MVV。这一比值反映的是呼吸肌和大气道主导的肺的通气功能。脑卒中后肺顺应性降低、气道阻力升高、呼吸肌力量和耐力降低等因素可能导致通气功能障碍,先前的研究也发现脑卒中后患者膈肌活动度下降。但本研究中,脑卒中患者的通气储备与健康人无明显差异,也不是影响CRF的主要因素,原因可能是研究对象不同。本研究已排除严重肺部疾患的患者,研究对象为能完成CPET评估的脑卒中患者,通气功能相对较好。但脑卒中患者若存在呼吸中枢功能失调引发呼吸模式改变、呼吸肌瘫痪等可导致通气功能障碍,表现为通气储备不足。
死腔分数是生理无效腔(volume of dead space,VD)与潮气量(tidal volume,VT)的比值。VD/VT反映的是气体交换的效率,运动后VD/VT未降低或升高,反映通气-血流比例失调。运动时的 VD/VTpeak>0.3表明肺血管床的结构和功能受损,气体交换效率低下。本研究中,脑卒中偏瘫患者的换气效率低于健康人,可能是肺部感染、肺血管床中微血栓形成等原因致患者运动期间肺灌注减少或弥散障碍,换气效率下降。虽然脑卒中患者的换气效率较健康人下降,但本研究结果显示,换气效率并不是无严重肺部并发症的脑卒中偏瘫人群CRF的限制因素。
AT/VO2peak%pred 为无氧阈 (anaerobic threshold,AT)与预测VO2最大值(VO2peak pred)比值的百分比。AT是运动时肌肉需氧量高于供氧量的临界点时的VO2,在这个临界点以下,有氧代谢可以充分满足运动时的能量供应;在这个临界点以上,有氧代谢已经无法满足组织对能量的需求,需要无氧代谢来补充能量供给。本研究采用V-斜率法来测定AT,CO2的排出相对于O2的摄入开始增加的时刻即斜率改变点的VO2即为AT。肌肉的氧化能力是AT的决定性因素。因此,AT可以用于评价骨骼肌的功能状态,AT越低,骨骼肌对运动的限制就越大。在正常、未经训练的个体中,AT发生在50%~60% 的预测VO2最大值。本研究结果显示,脑卒中患者的 AT/VO2peak%pred显著低于健康对照,原因可能是卒中后骨骼肌代谢异常致有氧运动能力受损的脑卒中患者会比健康人更早地达到AT,提前动用无氧代谢来补充能量供给以完成运动。
单因素分析显示,患者的性别、身高、体质量和BMI与VO2peak不相关,原因可能是本研究的受试者为脑卒中偏瘫患者,其 VO2peak主要受限于身体活动水平,性别、身高、体质量和 BMI等因素与之相比,影响较小。回归分析发现,骨骼肌有氧代谢能力是影响脑卒中偏瘫患者CRF水平最关键的因素。卒中后骨骼肌结构和功能的异常致其对氧的摄取和利用受限。结构上可能与慢肌(Ⅰ型)纤维改变、肌肉微循环受损有关,功能上可能与线粒体数量减少、血管舒张因子减少、氧化酶活性下降有关。这些变化导致运动过程中无氧代谢出现的时间提前和肌肉的早期疲劳。
既往对偏瘫侧肌肉的研究显示,卒中后骨骼肌Ⅰ型肌纤维丢失,肌纤维萎缩,纤维类型比例改变。慢肌纤维具有较强的氧化功能,更耐疲劳,对胰岛素介导的葡萄糖摄取更敏感,而快肌(Ⅱ型)纤维被招募用于更快速和更有力的运动,它们快速疲劳,对胰岛素的作用不太敏感。脑卒中导致的肌纤维表型的改变使骨骼肌更易疲劳并加重胰岛素抵抗。骨骼肌表型的表达取决于特定的神经支配模式和对肌肉的刺激。脑卒中后神经支配改变可能是肌肉表型变化的部分原因,活动水平下降和负重能力降低也可导致这些变化。
常规的传统卒中康复主要集中于优化肢体功能障碍,不能提供足够的有氧刺激,以逆转久坐或久卧脑卒中人群的运动不耐受,这可能恶化心血管健康状况并导致多种并发症的发生。本研究强调评估脑卒中患者运动耐量的重要性,并采取措施改善这一人群的CRF水平。康复治疗应围绕骨骼肌功能和心功能进行针对性干预,增加功能性肌肉的质量和数量以及提高心脏储备能力,有氧耐力训练结合适当的阻力训练应纳入脑卒中患者的康复管理中。如条件许可,每位运动不耐受的脑卒中患者都应行CPET评估,从CPET获得的信息可以识别运动受限的原因,改变管理策略。未来可考虑将CPET作为评估和管理脑卒中患者的常规方法,对涉及神经心理、呼吸、循环和骨骼肌器官系统的有氧运动反应进行全面评估,并考虑适当的药物或康复干预。
4 结论
脑卒中偏瘫患者的CRF水平显著低于健康人;脑卒中后患者的每搏输出量、换气效率、骨骼肌有氧代谢能力均降低,通气功能所受影响较小。骨骼肌有氧代谢能力和心脏泵血功能是脑卒中偏瘫患者CRF水平的主要影响因素。其中,骨骼肌有氧代谢能力是决定脑卒中偏瘫患者运动耐量的最关键因素,骨骼肌利用氧的能力越强,CRF水平越高,对运动的适应性越强。为改善脑卒中患者的运动不耐受,可在常规康复治疗的基础上增加有氧耐力训练结合适当的抗阻运动以提高CRF水平,改善患者的功能结局。
参考文献:略
作者:陈蒙晔 曲庆明 朱杰 陈祥贵 贾杰
单位: 苏州大学附属第四医院
复旦大学附属华山医院
南通大学附属医院
复旦大学附属华山医院静安分院
来源:中国康复理论与实践2025年4月第31卷第4期
声明:
1.本网站所有内容,凡是注明 “来源:心脏康复网”的文字、图片和音视频资料,授权转载时须请注明“来源:心脏康复网”。
2.本网所有转载文章系出于学术分享的目的,版权归原作者所有。如有侵权,请及时联系我们更改或删除。