1 引言
在过去40年中,全球肥胖患病率几乎增加了两倍,并且在世界许多地区还在继续增加。近来流行病学研究发现在美国,至少有35%的男性和40%的女性存在肥胖。根据世界卫生组织(WHO)定义体质量指数(BMI)在 30 或以上为肥胖,已证实BMI与2型糖尿病、高血压、血脂异常、心血管疾病(cardiovascular disease,CVD)和多种癌症的风险增加显著关联,然而BMI不能准确且有效的评估脂肪分布及健康状况,因此,代谢健康概念的引入尤为重要,在肥胖的人群中一部分表现为更高的代谢紊乱风险,例如胰岛素抵抗、空腹血糖和/或耐受量受损、血脂异常和高血压,即代谢不健康型肥胖(metabolically unhealthy obesity,MUO),而另一部分人群却没有出现高血压、高血糖及高血脂等代谢紊乱和心血管疾病,即代谢健康型肥胖(metabolically healthy obesity,MHO),这类人群常具有三个主要临床特征:内脏脂肪和异位脂肪的积累减少,胰岛素敏感性保留,以及与MUO个体相比,全身和脂肪组织炎症程度较低。
虽然MHO没有标准化的定义,但除了肥胖(BMI≥30kg/m)的诊断外,还提出了以下标准):空腹血清甘油三酯≤1.7mmol/L(≤150mg/dL);高密度脂蛋白胆固醇>1.0(>40mg/dL)(男性)或>1.3mmol/L(>50mg/dL)(女性);收缩压(SBP)≤130mmHg;舒张压 ≤85mmHg;空腹血糖≤6.1mmol/L (≤100mg/dL);没有血脂异常、糖尿病或高血压的药物治疗;且无心血管疾病表现。另外也有一些指标,例如内脏肥胖指数(visceral adiposity index,VAI)和脂肪肝指数,被用来评估代谢健康,这两个指标都与炎症通路有关,被认为是代谢综合征的早期预测因子。MHO患病率评估差别较大,的主要问题是对其定义缺乏共识。第三次美国全国健康和营养检查调查(NHANES III)的数据显 MHO的患病率为47%。在中国成年人口的随机样本中,MHO的患病率在4.2%至13.6%。在欧盟生物样本库标准化和协调卓越研究(BioShare-EU)项目显示,在1,1465名肥胖男性和1,6612名肥胖女性中,所有队列中 MHO 的年龄标准化患病率为12%,欧洲不同地区的队列之间存在很大差异,对于男性来说,MHO的患病率最高是意大利的CHRIS研究(为19%),其次是德国的KORA研究(13.5%),而与男性相比,女性的MHO患病率普遍较高。最近一项纳入全球12项队列和7项干预研究的荟萃分析发现,MHO的患病率为 35%,但具有显着的区域差异 。
2 MHO和MUO的人群临床特征:
MHO与MUO的临床表现和行为特征存在不小的差异。与MUO个体相比,MHO个体的特征是肝脏和内脏脂肪较低,但皮下腿部脂肪含量较高,心肺健康和身体活动能力较强,胰岛素敏感性较低,炎症标志物水平较低,脂肪组织功能正常。尽管两种人群的总脂肪量相似,但脂肪分布有一定差别(见图1)。
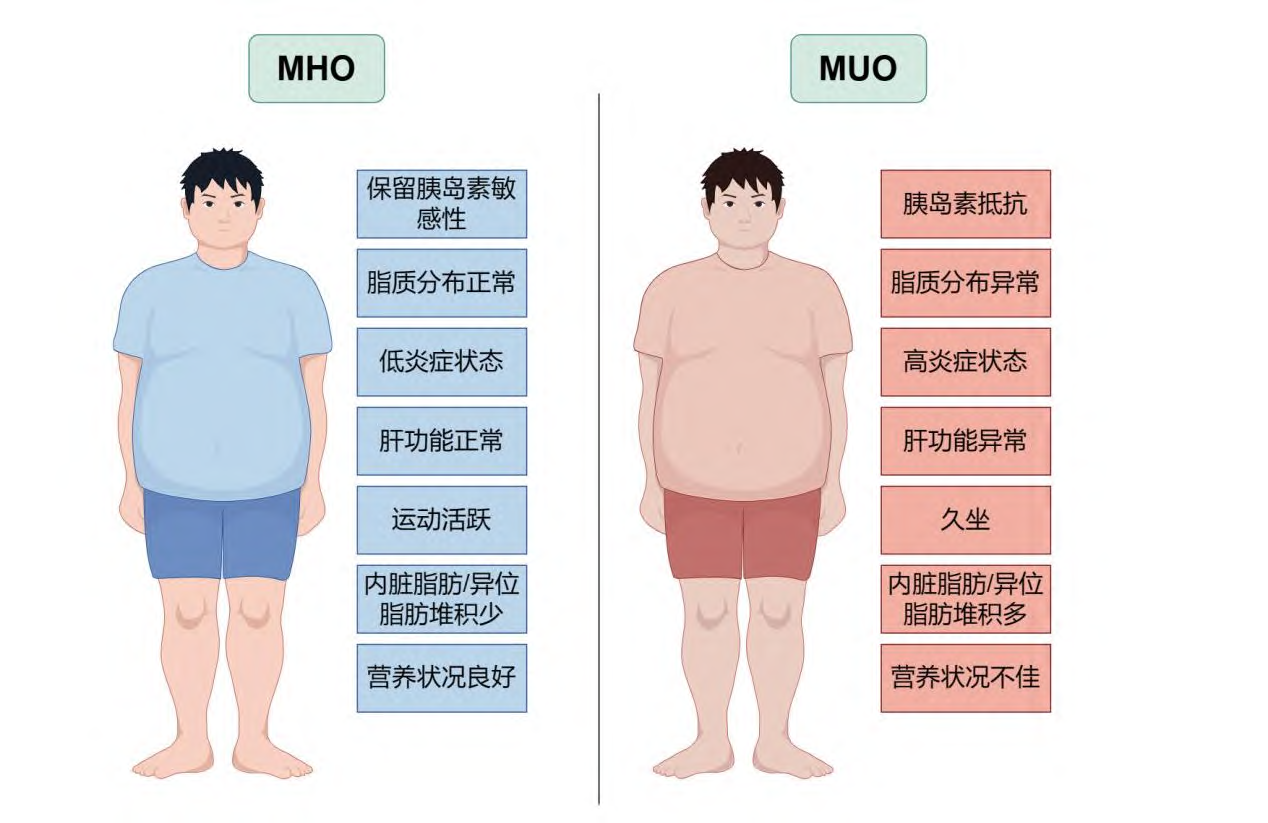
2.1 MHO(代谢健康肥胖)人群特征:
(1) 肝脏和内脏脂肪较低:MHO个体的肝脏脂肪含量相对较低,这意味着他们患非酒精性脂肪肝病(NAFLD)的风险较低。内脏脂肪的减少也降低了患CVD的风险。
(2) 皮下腿部脂肪含量较高:与内脏脂肪相比,皮下脂肪通常被认为是较为“健康”的脂肪储存形式。MHO个体的腿部皮下脂肪含量较高,这可能有助于他们维持较好的身体活动能力。
(3) 心肺健康和身体活动能力较强:MHO个体通常具有较好的心肺功能和较高的身体活动水平,这有助于他们维持较高的能量消耗和较好的代谢健康。
(4) 胰岛素敏感性较低:尽管MHO个体的胰岛素敏感性相对较低,但他们的胰岛素分泌能力可能较强,这有助于他们维持正常的血糖水平。
(5) 炎症标志物水平较低:MHO个体的炎症水平通常较低,这表明他们的身体炎症反应较为温和,这可能有助于减少慢性疾病的风险。
(6) 脂肪组织功能正常:MHO个体的脂肪组织功能通常保持正常,这意味着他们的脂肪细胞能够正常地储存能量并响应身体的代谢需求。
2.2 MUO(代谢不良肥胖)人群特征:
(1) 内脏脂肪堆积:MUO个体的内脏脂肪通常较高,这与多种代谢疾病的风险增加有关,如2型糖尿病、高血压和心血管疾病。
(2) 异位脂肪积累:MUO个体可能出现在非典型部位(如肝脏、胰腺、心脏和肌肉)的脂肪积累,这种异位脂肪的积累与代谢紊乱和CVD风险增加有关。
(3) 代谢紊乱:MUO个体通常存在胰岛素抵抗、血糖升高、血压升高和血脂异常等代谢异常,这些因素增加了他们患心血管疾病和2型糖尿病的风险。
内脏脂肪和异位脂肪的积累是导致代谢紊乱和CVD风险增加的重要危险因素,MUO个体更容易出现内脏脂肪堆积和异位脂肪积累。已知体脂分布是重要的代谢和心血管危险因素,尽管有证据表明性激素、糖皮质激素的使用、基因组成和表观遗传机制在体脂分布中发挥重要作用,然而体脂分布个体间差异的机制很复杂,仍有待阐明。
3 MHO与MUO个体代谢状态的转变
代谢状态并非一成不变,越来越多的证据提示代谢状态之间存在相互转变,不少证据提示MHO是一种短暂性表型,而是一个发展阶段,一些研究报告说,大多数MHO个体者最终会转变为MUO,在4~15.5年的随访时间里,转化率从30.6%到87.1%不等。在前瞻性Pizarra研究的参与者中,大约30%在基线时被诊断患有MHO的个体在6年的随访调查中转化为MUO。来自英国的一个大型初级保健数据库(CPRD)的最新调查记录了包含23,1399名BMI为≥35kg/m2的患者的数据,结果发现男性更容易从MHO过渡到MUO。此外,与绝经前妇女相比,绝经后MHO的患病率较低,绝经期间从MHO到MUO的转化率为30%,这表明性激素的变化可能在从MHO到MUO的转变中发挥作用。同样,MUO尽管被看作疾病状态,但其也并非一成不变,也可根据针对性的干预而逆转。由此可见,代谢健康不是一种稳定的状态,不仅取决于肥胖状态,而且会随着年龄的增长和雌激素减退而发生转变。尽管MHO的状态并不稳定,但定义MHO仍然有意义。它的意义在于提醒MHO个体,他们仍然有机会通过体重管理来预防、减轻和降低代谢综合征和CVD风险。
4 MHO与MUO个体的心血管风险
近年来,MUO个体的心血管风险较高已成为公认的事实,一项来自英国生物银行队列报道与 MHO个体相比,MUO个体与CVD风险增加74%显著相关,MUO个体心血管疾病风险增加显著相关,另一项来自韩国的人群的前瞻性研究结果显示在韩国人群中,与非肥胖参与者相比,MHO个体的全因死亡风险降低,而MUO个体的CVD死亡风险显著升高。
相反,MHO前期被认为是一种“良性疾病”,MHO个体患CVD的风险似乎较低。尽管高 BMI或代谢综合征与CVD之间存在密切联系,但已有基于人群的证据显示无代谢异常的肥胖不会增加人群的CVD风险。此外,前瞻性研究的荟萃分析一致表明,MHO与2型糖尿病和心血管疾病的发病率显着降低有关。另一项荟萃分析表明,MHO个体的CVD风险增加远低于MUO个体,但MHO个体发生心肌梗塞、缺血性中风或心血管死亡的风险并不高于代谢健康且没有肥胖症的个体。可见,既往不少证据证实MHO个体发生心血管并发症的风险并不高。
然而,随着大型流行病学研究逐渐深入,MHO是肥胖的良性亚表型的观点受到挑战,这些数据表明,与代谢健康的正常体重人群相比,MHO个体发生急性心血管事件、脑血管疾病、心力衰竭、2型糖尿病和全因死亡率的风险更高。一项荟萃分析纳入了41项基于人群的大型前瞻性研究,结果显示,相较于代谢健康正常体重人群,MHO个体的心血管风险及全因死亡风险增加;来自中国人群队列提示在中国成年人中,MHO个体发生血管事件(冠状动脉事件、中风等)的风险增加。三个社区队列研究显示MHO个体存在微血管功能受损,尽管受损程度不如MUO个体那么明显。因此,MHO个体通常并不真正健康,而只是心脏代谢异常比定义为 MUO的人群少。迄今为止的研究尚未证明MHO和MUO在生活方式因素(饮食成分、身体活动和睡眠)方面存在重要差异,而遗传因素也能在代谢中发挥重要作用。一项来自两个欧洲中心人群队列研究表明MHO个体可能不会表现出较高的短期心血管风险,但往往具有与较高心血管风险相关的代谢组学表征(例如:MHO个体往往具有导致动脉粥样硬化脂蛋白谱,其特征是极低密度脂蛋白和低密度脂蛋白水平升高,高密度脂蛋白水平降低),因此仍需要早期干预。Huang 等研究为 MHO作为亚临床血管疾病的风险状态提供了令人信服的证据,虽然不像不健康的肥胖那样有害,但健康的超重/肥胖仍然具有更高的颈动脉粥样硬化的概率,颈动脉粥样硬化随着2年内代谢状态异常,转化率也随之增加。来自霍普金斯医学院的社区动脉粥样硬化风险(ARIC)研究中对9477名成年人进行了横断面和前瞻性分析表明MHO个体的CVD风险介于代谢健康的正常体重和MUO个体之间。一项从心肌组织层面来揭示MHO和MUO个体在左室射血分数没有显著差异,但均存在心肌重塑(MHO:44%vsMUO:71%)。由此可见,尽管MHO个体未来发生 2 型糖尿病和CVD的风险低于MUO个体,但大多数MHO个体仍存在长期心血管风险,因此,更倾向于将其被看作疾病的一种过渡状态,而非健康状态,值得临床工作者的关注。
5 脂肪细胞功能与MHO与MUO个体代谢异质性及心血管风险的关系
代谢异质性是指即使在相同的体重指数(BMI)下,不同个体的代谢状态可能不同,这种代谢差异涉及遗传、环境和生活方式等多种因素的调控,在调控机制的核心环节是脂肪组织功能。目前人们普遍认为,脂肪组织功能受损和脂肪组织异位沉积是导致肥胖相关代谢异常的决定因素,机体脂肪组织可分为白色脂肪组织(White adipose tissue,WAT)和棕色脂肪组织(Brown adipose tissue,BAT),WAT主要负责能量储存,与胰岛素抵抗、炎症状态及代谢综合征密切相关,而BAT则通过产热来增加能量消耗,发挥抗肥胖及抗代谢综合征的作用。
WAT主要参与机体的代谢紊乱,生理状态下WAT有两个主要功能作用:首先,脂肪细胞在胰岛素的合成代谢作用下储存甘油三酯,甘油三酯由食物消化后的脂肪酸和葡萄糖合成。其次,在禁食期间,甘油三酯在胰高血糖素的分解代谢作用下发生脂肪分解,并通过门静脉循环将脂肪酸释放到外周组织,以便被外周细胞用作能量燃料(通过脂肪酸β氧化)。在热量摄入过多的条件下刺激脂肪细胞增生及扩张。但是一旦超过WAT的储存及扩张能力,则可能发生脂肪组织功能障碍,其特征是异位脂肪沉积(如肝脏、腹部内脏库、骨骼肌、胰腺)和脂肪细胞肥大(脂肪细胞肥大比脂肪细胞增生更不利于新陈代谢,因为肥大的脂肪细胞的快速扩增可能导致膜破裂和细胞死亡)、缺氧、血管形成不足、免疫细胞浸润、细胞凋亡和促纤维化细胞外基质蛋白的产生增加,导致纤维化,从而进一步加剧脂肪组织功能障碍,最终导致促炎、致糖尿病和致动脉粥样硬化信号(如脂肪因子、脂肪分解增加产生的脂肪酸、其他代谢物、免疫细胞)的释放,从而出现胰岛素抵抗、血脂异常等代谢紊乱。此外,WAT在生理和病理条件下都具有显着异质性和可塑性,这种可塑性决定代谢表型,其可受到遗传因素的调节,并对环境因素(如生活方式、饮食习惯等)的相关刺激做出反应。WAT的重塑(增生或肥大)可以是健康的,也可以是不健康的,这取决 WAT扩张重塑的形式和WAT的微环境。
在MHO个体中,WAT通过增加脂肪细胞增生、抗炎微环境、适当的细胞外基质重塑、适当的血管化、增强的 WAT褐变和皮下脂肪组织沉积来减少异位脂肪沉积和胰岛素抵抗。其中,WAT褐变指的是传统的储能型白色脂肪细胞转变为具有产热功能的米色脂肪细胞(米色脂肪细胞在特定条件下(如寒冷、运动等)可以转变为具有产热功能的细胞,类似于棕色脂肪细胞),在寒冷暴露、运动和间歇性禁食、甲状腺激素、纤维母细胞生长因子21(FGF21)和脂联素诱导下发生,WAT褐变过程常常伴有解偶联蛋白1(UCP1)基因的表达显著增加(UCP1是产热过程的关键蛋白)以及其他调节线粒体脂肪能量代谢的相关基因表达(包括 PRDM16、PGC-1α、PPARγ等)。WAT褐变增加能量的消耗、改善了胰岛素敏感性并降低代谢综合征的发生风险。
反之,在MUO个体中,WAT 重塑则会导致异位脂肪沉积和胰岛素抵抗,造成代谢紊乱。这一过程包括脂肪细胞肥大、血管化破坏、增强的促炎微环境、增强的BAT变白和内脏脂肪组织沉积。其中,BAT变白指的是棕色脂肪细胞逐渐失去其产热功能和特征,变得更类似于白色脂肪细胞。这一过程通常伴随着线粒体功能的下降、脂质沉积的增加、促炎因子(IL-6、TNF-α)的表达以及 UCP1表达的减少。
可见,脂肪组织的重塑深刻影响着机体的代谢状态。WAT 褐变通过增加能量消耗、改善胰岛素敏感性和降低炎症,有助于维持MHO个体的代谢健康。而BAT 变白通过减少能量消耗、增加脂肪积累和加重代谢紊乱,促进MUO个体的代谢紊乱。
MHO个体及 MUO个体的脂肪组织的分布及其对过量能量摄入的反应存在相当大的差异。MHO个体在能量摄入过多时通常表现出健康的脂肪组织扩增,通常伴有更小和更多的脂肪细胞,反之,MUO个体再过多能量摄入时多表现为脂肪细胞肥大和脂肪异位沉积。正是由于这种差异导致代谢表型的不同,其是由环境和遗传因素共同决定。环境因素中良好的生活方式(体力活动、低糖饮食、低饱和脂肪酸饮食)可以调节全身能量代谢及脂肪分布,有证据表明,在高热量摄入期间,同时进行的身体活动会增加外周组织中游离脂肪酸的线粒体氧化,促进脂肪的健康代谢。基于人群的研究同样提示,与MUO个体相比,MHO个体在中度至剧烈的身体活动中花费的时间更多,而久坐不动的时间更少。此外,体内脂肪的数量和分布以及脂肪细胞的数量受到遗传因素的控制,GWAS研究已经揭示了许多可能调节脂肪组织分布的基因型(例如 TBX15、HOXC13、RSPO3 和 CPEB4),可见生活方式及遗传背景很大程度上决定了脂肪的分布及脂肪对能量的反应。
脂肪组织不仅影响代谢表型,其与心血管系统关系同样密切,在解剖学结构上,大部分循环系统被脂肪组织覆盖,功能评估上,来自形态学、转录谱和蛋白质组分析的最新数据一致表明,血管周围脂肪组织表现出更多棕色脂肪组织(BAT) 的特征,在健康代谢中,血管周围脂肪组织的促收缩活性和抗收缩活性之间的微妙平衡对于维持血管稳态和正常血压至关重要。然而,血管周围脂肪组织在肥胖条件下失去其 BAT 样特征并促进炎症因子浸润、血管周围脂肪组织功能失调,目前研究已经表明功能失调的血管周围脂肪组织的过度积累已被认为是内皮功能障碍和动脉粥样硬化的主要危险因素,发炎的脂肪组织通过多种机制导致血管功能障碍,首先,局部缺氧和炎症消除了血管周围脂肪组织的保护性抗收缩特性,并将血管周围脂肪组织的旁分泌作用转变为血管收缩,从而导致血管张力升高、血管痉挛倾向和血流动力学受损。其次,发炎的血管周围脂肪组织产生的大量趋化因子,如趋化因子(MCP-1、IL-8 等)诱导单核细胞、淋巴细胞和中性粒细胞向血管壁募集和浸润,从而引发局部血管炎症。第三,发炎的血管周围脂肪组织分泌多种脂肪源性促炎细胞因子和脂肪因子,例如 TNF-α、抵抗素和脂肪酸结合蛋白 A(A-FABP),以内分泌和/或旁分泌方式作用于内皮细胞,损害内皮细胞一氧化氮的产生并诱导细胞凋亡,从而导致内皮损伤。最后,炎症脂肪组织分泌的因子,如瘦素和内脂素,可以刺激内皮细胞增殖和迁移,并促进新内膜形成。基于上述机制,发炎的血管周围脂肪组织促进动脉粥样硬化的形成,促进心血管疾病的发生。
对于个体健康而言,生活方式的干预不失为一种有效方式,改善脂肪细胞的炎症状态、代谢表型、减轻体重以及维持健康的心血管系统。例如,低碳水化合物和极低碳水化合物饮食、低脂肪/高脂肪或高蛋白饮食、代餐和调节热量摄入时间的饮食(间歇性禁食),以及地中海饮食模式均可以降低肥胖人群的心血管风险。在体力活动方面,越来越多的证据表明,在内脏肥胖患者中,在没有低热量饮食干预的情况下,有氧运动仍然能够来降低心血管风险。因此,理解代谢异质性背后的机制以及有效的行为和分子干预策略,对于预防和管理肥胖相关的心血管疾病具有重要意义。
综上所示,代谢健康状态对肥胖个体的心血管风险具有重要影响,无论代谢状态如何都会导致增加心血管风险,只是MUO个体的心血管风险更高,而MHO并非良性疾病而是一种过渡状态,MHO个体的远期心血管风险仍存在,早期关注制定行为干预或饮食干预可能针对性的降低MHO个体的心血管风险。脂肪细胞功能作为代谢及血管内皮稳态的关键因素,在调控代谢表型及心血管健康方面发挥不可忽视的作用。未来的研究可探索MHO和MUO的病理生理机制为揭示脂肪堆积、不良脂肪分布和脂肪组织功能障碍如何导致代谢和心血管异常的机制提供新的见解,有助于确定肥胖相关的心血管并发症的高危因素及早期诊断靶点,从而早期识别并进行有效干预以帮助降低肥胖人群的心血管风险。
参考文献:略
作者:崔莹 牛泽家馨 汪洋
单位:西安国际医学中心医院
西安交通大学第一附属医院
来源:《中国动脉硬化杂志》
声明:
1.本网站所有内容,凡是注明 “来源:心脏康复网”的文字、图片和音视频资料,授权转载时须请注明“来源:心脏康复网”。
2.本网所有转载文章系出于学术分享的目的,版权归原作者所有。如有侵权,请及时联系我们更改或删除。